Les bases de la radioactivité
Publié le 17 novembre 2021
Vulgarisation scientifique des bases de la radioactivité.
Lecture 3 min
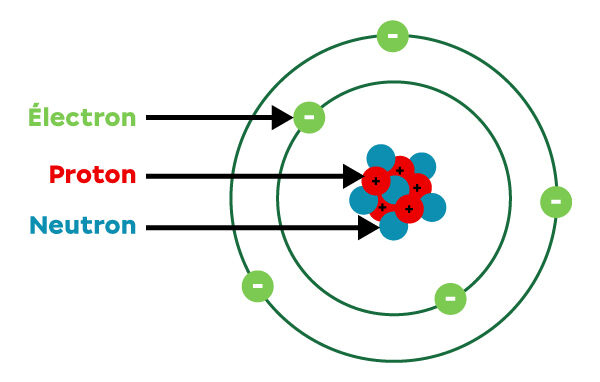
Atome
Un atome est constitué de protons, de neutrons et d’électrons.
Un élément chimique est défini par le nombre de protons de son noyau (le numéro atomique).
Ils peuvent avoir différentes variantes, avec un nombre de neutrons différent, on appelle cela un isotope.
On les distingue par le nombre total de protons et de neutrons dans leurs noyaux (le nombre de masse).
Un atome (le carbone par exemple, numéro atomique 6, donc 6 protons) peut avoir des isotopes stables (C 12 par exemple, qui a 6 protons et 6 neutrons) puis d’autres, instables et donc radioactifs (C 14 par exemple, qui a 6 protons et 8 neutrons).
Rayonnements
La radioactivité est l’émission de rayonnements par une substance inerte sans apport d’énergie extérieur.
Ces éléments radioactifs instables vont se désintégrer avec le temps et émettre des rayonnements.
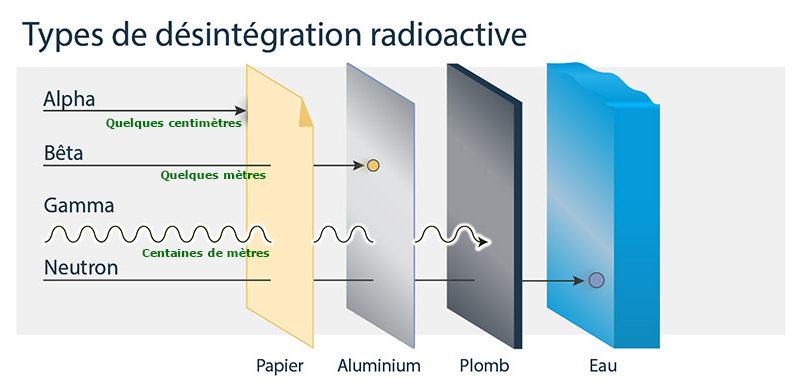
Les rayonnements produits peuvent être de 3 types :
-
Le rayonnement alpha (α) est émis par les atomes possédant trop de protons ou de neutrons. Il correspond à l’émission d’un noyau d’atome d’hélium, composé de deux protons et de deux neutrons : la particule alpha.
Sa portée dans l’air est de quelques centimètres. Il peut être arrêté par une simple feuille de papier. -
Le rayonnement bêta (β- ou β+) est émis par des atomes ayant un écart trop important entre le nombre de protons et de neutrons. Il peut être chargé négativement (électron) ou chargé positivement (positron).
Sa portée dans l’air est de quelques mètres. Il peut être arrêté par une feuille d’aluminium. -
Le rayonnement gamma (γ) est émis par les atomes possédant un trop plein d’énergie. Il s’agit d’une onde électromagnétique de même nature que la lumière ou les rayons X, mais beaucoup plus énergétique.
En fonction de son énergie, il peut parcourir plusieurs centaines de mètres dans l’air. Une forte épaisseur de plomb ou de béton est nécessaire pour les arrêter.
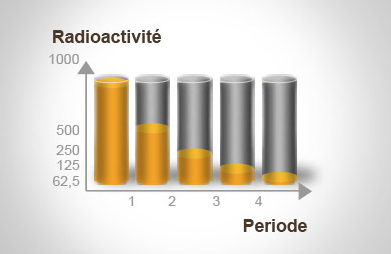
Période radioactive
Chaque isotope radioactif met un certain temps (période radioactive) pour que la moitié de ses atomes se désintègrent naturellement, indépendamment de son environnement (température ou pression).
On ne peut pas savoir quand un atome va se désintégrer exactement, on peut juste émettre des statistiques basées sur les probabilités qu’un des atomes se désintègre dans un temps donné.
La décroissance de ce nombre d’atomes suit une décroissance exponentielle.
La période radioactive d’un élément peut aller d’un temps très court (pour le Radon 220, c’est 54 secondes) à un temps très long (pour l’Uranium 238, c’est 4,5 milliards d’années).
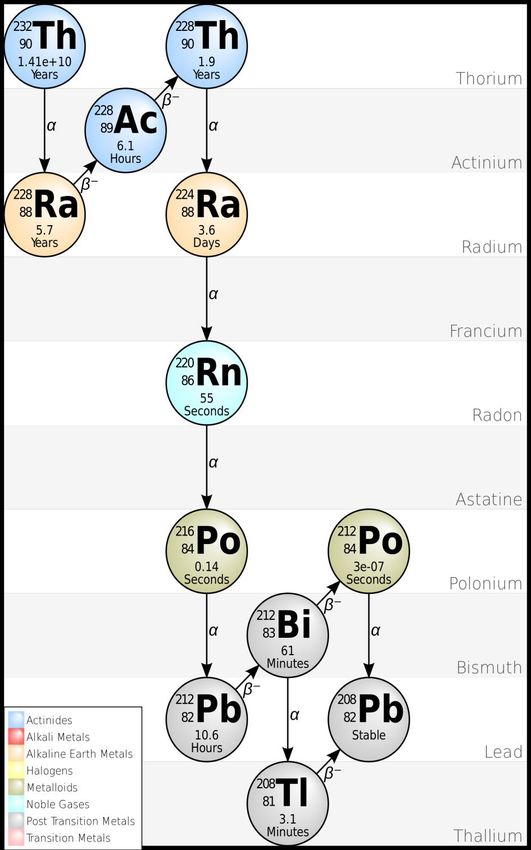
Chaîne de désintégration
En se désintégrant, les atomes radioactifs vont se transformer en de nouveaux atomes, on appelle ça la chaîne de désintégration.
Par exemple, le Thorium 232 va produire des rayonnements alpha et se transmuter en Radium 228.
Qui lui même va produire des rayonnements bêta et se transmuter en Actinium 228.
Ainsi de suite avec divers autres éléments radioactifs, jusqu’à arriver à du Plomb 206 qui est un isotope stable.
Images :
- https://www.alloprof.qc.ca/en/students/vl/sciences/the-history-of-the-atomic-model-s1109
- https://www.andra.fr/les-dechets-radioactifs/la-radioactivite/explication-du-phenomene
- https://nuclearsafety.gc.ca/fra/resources/radiation/introduction-to-radiation/types-and-sources-of-radiation.cfm
- https://www.utinam.cnrs.fr/?Thorium